- 10. Sınıf Fizik Konuları
- 11. Sınıf Fizik Konuları
- 12. Sınıf Fizik Konuları
- 9. Sınıf Fizik Konuları
- Atışlar
- Atom Fiziği
- Aydınlatma
- Bağıl Hareket Nehir Problemleri
- Basınç
- Basit Harmonik Hareket
- Basit Makineler
- Bilgiler
- Dalgalar
- Dinamik
- Doğrusal Hareket
- Düzgün Dairesel Hareket
- Düzlem ve Küresel Aynalar
- Elektrik
- Elektrik Akımı
- Elektromagnetik
- Elektrostatik
- Fiziğin Doğası
- Fizik
- Fizik Öğretimi
- Fizik Öğretmeni
- Fizik Simülasyonları
- Gölge
- Haber
- Hesaplamalar
- Isı ve Sıcaklık
- Işığın Kırılması ve Renk
- Işık
- İş Güç ve Enerji
- İtme Momentum Açısal Momentum
- Kuvvet Denge
- Kütle Ağırlık Merkezi
- Kütle Çekimi ve Kepler
- Lambalar
- Alan Yeterlilik Sınavı AYT
- Madde ve Özellikleri
- Manyetizma
- Mekanik
- Mercelekler
- Modern Fizik
- Modernfizik
- Moment - Tork- Dengesi
- Nükleer Fizik
- Optik
- Periyodik Hareketler
- Sıvıların Kaldırma Kuvveti
- Vektörler
- Temel Yeterlilik Sınavı TYT
Güncelleme / Ekleme :28/10/2008
Pillerin içindeki maddeler kimyasal tepkimeye girerek elektron
açığa çıkarırlar dolayısıyla kimyasal enerji elektrik enerjisine
çevrilmiş olur.
Bu olayın tersine yani elektrik enerjisiyle kimyasal tepkimeler
oluşturulmasına elektroliz denir.
Pillerin doldurulması, suyun oksijen ve hidrojen gazına ayrılması
ve metal kaplama işlemleri elektroliz olayıdır.
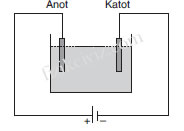
Elektroliz olayının gerçekleştirildiği şekildeki kaba elektroliz
kabı, kabın içindeki iletken sıvıya elektrolit, elektrolit içine batırı-
lan metallere de elektrod denir. Üretecin potizif kutbuna bağlı
elektroda anot, negatif kutba bağlı elektroda da katot denir.
Elektrik enerjisi yardımıyla kimyasal tepkime oluşturabilmek
için sıvıdan akım geçebilmeli dolayısıyla elektroliz kabındaki sı-
vı iletken olmalıdır. Bu nedenle elektroliz kaplarında asit, baz ve
tuz çözeltileri kullanılır.
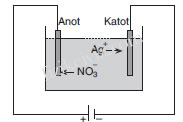
Şekildeki gibi AgNO3 çözeltisi olan elektroliz kabından elektrik
akımı geçirilirse, AgNO3 suda
AgNO3 › Ag+ NO–
3
şeklinde çözünür. Anot ile katot arasındaki elektrik alanından
dolayı Ag+ iyonları, katota doğru, NO–
3 iyonları da anota doğru
hareket ederler.
Katota ulaşan Ag+ iyonları, katottan bir elektron alarak nötr
hale geçer ve katot üzerinde toplanır. Böylece katot gümüşle
kaplanmış olur.
NO–
3 iyonları da anota ulaşınca bir elektron vererek nötr hale
geçerler. Dolayısıyla anotun aldığı elektronlar iletken tellerde
hareket ederler.
Yükünü kaybeden NO–
3 de anottaki gümüşü eriterek,
NO–
3 + Ag+ › AgNO3
AgNO3 oluşturur.
Bu AgNO3 de Ag+ ve NO–
3 iyonlarına ayrışır.
Dolayısıyla anotta gümüş azalırken katotta gümüş toplanır.
Yapılan deneylerde anottaki gümüşün kütlesindeki azalma miktarı
nın katottaki gümüş kütlesinin artış miktarına eşit olduğu görülmektedir
Yapılan deneyler sonucunda bir elektroliz olayında ayrışan
ve elektrotlarda toplanan madde miktarının,
1. Akım şiddeti ile doğru orantılı
2. Akımın geçiş süresi ile doğru orantılı
3. Elementin değerliği ile ters orantılı
olduğu anlaşılmıştır.
Uyarı: Elektroliz kaplarının bir direnci vardır ve
elektroliz kapları Ohm yasasına uymaktadır.
SUYUN ELEKTROLİZİ

Suyun elektrolizi olayında H2O molekulu hidrojen ve oksijen
gazlarına ayrılmaktadır.
Su iyi bir iletken olmadı.ından su icine bir miktar H2SO4
damlatılarak iyi bir iletken haline getirilir.
Şekildeki devreden akım gecirilince X ve Y tuplerinde gaz
kabarcıklarının yukseldi.i ve bu gaz kabarcıklarının tuplerin ust
kısımlarında toplanarak su seviyelerini alcalttı.ı gorulur. Ayrıca
katottaki su seviyesinin anottakinin iki katı alcaldı.ı anlaşılmıştır.
Buradan anotta bir hacim gaz ayrıştı.ında katotta iki hacim gaz
ayrıştı.ı sonucu cıkmaktadır.
Asitli suda sulŞrik asit molekulu,
H2SO4 ?› 2H+ + SO–2
4
şeklinde iyonlarına ayrışır. Elektrotlar arasındaki elektrik alandan
dolayı H+ iyonları katoda do.ru hareket ederler ve katottan
elektron alarak notrlenirler ve gaz olarak acı.a cıkarlar. Dolayı-
sıyla katotun bulundu.u tupte hidrojen gazı birikir.
Cozeltideki SO–
4 iyonlarıda anota do.ru suruklenirler ve bir
elektronlarını vererek notr hale gelirler. Bu notr SO4 su ile tepkimeye
girerek,
1
SO4 + H2O ?› H2SO4 + –– O2 2
H2SO ve oksijen gazı oluştururlar. Dolayısıyla anotta da oksijen
gazı toplanır.
Yapılan deneyler devreden 1 Coulomb luk yükün geçmesi
durumunda yaklaşık olarak, 0,12 cm3 hidrojen ve 0,06 cm3 oksijen
gazının açığa çıktığını göstermiştir.
Uyarı:
* Bir elektroliz kabındaki (+) kutba bağlı tüpte oksijen,
(–) kutba bağlı tüpte hidrojen gazı birikir.
* Biriken gazların hacmi devreden geçen yük ile dolayı-
sıyla akım şiddeti ve akımın geçme süresiyle doğru orantılı-
dır.
* Bir elektroliz kabında t sürede V hacminde oksijen gazı
birikirse, 2V hacminde hidrojen gazı birikir.
Etiketler (elektrik, akımının, kimyasal, tepkisi, elektroliz, )
Tarafımızca yazılan yazıların hakları saklıdır.
Yorumlar (16)1312
Türkçemizi katletmeden harf ve imlâ yapımıza uyacağınızı düşünüyoruz.
Uygunsuz içerikler savcılığa bildirilmek üzere kayıt altına alıyoruz.
14.02.2025, 03:42
Her hakkı saklıdır.
Görüntüleme 33050